真核生物的基因表达需要成熟的mRNA从细胞核选择性转运到细胞质进行翻译。新生成的mRNA被加工和包装成核糖核蛋白复合物(mRNPs)后,通过必需转录输出复合物(TREX)识别输出。然而,mRNP识别和三维组织的机制尚不清楚。
近日,维也纳生物中心分子病理学研究所在Nature (IF: 69.504)杂志上发表了名为mRNA recognition and packaging by the human transcription-export complex的研究。研究报道了重组和内源性TREX – mRNA结构,并提出了核mRNA识别和包装的机制。

1 冷冻电镜分析
TREX通过其ALYREF亚基多价作用于mRNA结合的EJC(外显子连接复合体)。为了解其相互作用机制,作者重组了一系列不同RNA长度(15或50个核苷酸) 的ALYREFN-EJC-RNA多聚体复合物。ALYREF截断实验显示,ALYREF (55-182) (残基55-182) 是ALYREF - EJC – RNA有效重构和多聚的必要条件。ALYREF (55-182)-EJC-RNA复合物的多聚合依赖于蛋白-蛋白接触。作者随后纯化分析了此复合物六聚体的冷冻电镜结构。
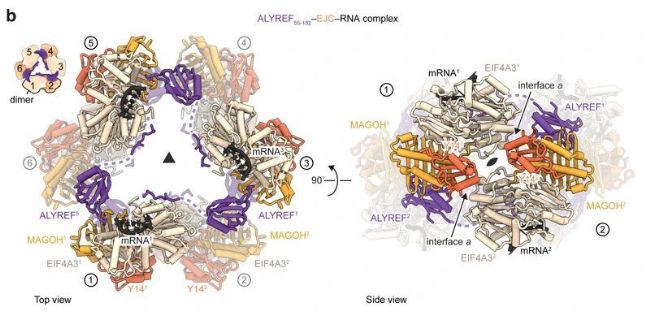
图1b. ALYREF55-182–EJC–RNA复合体冷冻电镜分析(俯视图和侧视图)
ALYREF-EJC-RNA复合体结构
ALYREF (55-182)-EJC-RNA的每个原聚体提供一个EJC – EJC(图1b左)和三个ALYREF - EJC接口(扩展图2h),通过保守的ALYREF –EJC多价作用(扩展图2i),连接成一个环。为维持这种结构,ALYREF WxHD(界面b) 或RRM结构域(界面c和d) 突变,防止体外ALYREF - EJC - RNA复合物的形成和多聚。
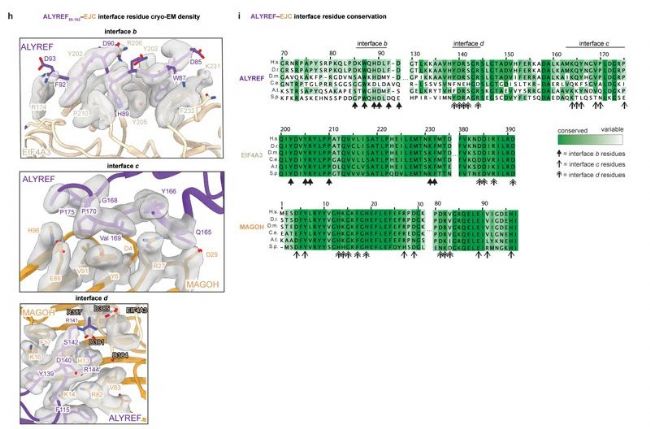
扩展图2h. ALYREF - EJC接口:ALYREF WxHD(界面b) 及RRM结构域(界面c和d) ;i. ALYREF、EIF4A3和MAGOH中ALYREF - ejc界面残基多序列比对
该结构中,一个ALYREF分子桥接三个EJC-RNA复合物。两个EJC分别连接mRNA两端,ALYREF结合后使两个EJC靠近及mRNP压实。此外,ALYREF结合域1、2(RBD1和RBD2)结构域中富含Arg - Gly的保守基元是体外结合RNA所必需的。
综上,ALYREF-和EJC介导的mRNP识别和包装可能依赖于多价蛋白和蛋白- mRNA的相互作用。
ALYREF 将 mRNP桥接到 THO–UAP56
冷冻电镜结果显示(扩展数据图2h),只有ALYREF WxHD和RRM区域接触EJC-RNA复合物。因此,ALYREF将EJC-RNA复合物与THO - UAP56的桥接,可能是通过其保守的多拷贝UAP56结合基(UBMs)实现。ALYREF-RNA结合活性包含在RBD1和RBD2结构域中。RNA过滤结合亲和力试验表明,RBD1和RBD2可能有助于RNA传递到UAP56,但对其与ALYREF55-182的结合无效。实验采用Sapphire激光扫描成像系统检测RNA的标记荧光信号(488nm,Azure Biosystems),GraphPad Prism函数拟合计算亲和力。
核提取物和体外生化数据支持这一模型。数据表明,ALYREF和THO的多价相互作用可能对TREX在mRNPs上的组装以及UAP56向mRNA的有效递送很重要。
进一步结构分析显示,只有结合了mRNA的EJC才能形成多价ALYREF-EJC复合物,这表明mRNA前剪接可能先于mRNP包装。
2 TREX-mRNP结构与接触
TREX-mRNP多价模型
作者随后对TREX-mRNP进行体外交联及冷冻电镜分析,与其天然配合物对比显示:体外重建的ALYREF - EJC相互作用也发生在天然配合物中。此外,本研究确定了CBC内以及EJC EIF4A3亚基与PSAP复合物亚基PININ之间的交联,可与各种输出适配器协同作用,并导致多价TREX-mRNP组装。
TREX–mRNP 冷冻断层扫描密度与冷冻电镜结构非常吻合。
TREX复合物包被在mRNP表面
TREX复合物仅在mRNP表面结合,其四个UAP56亚基面向mRNP(图4a, b)。但综合分析表明,TREX复合物与mRNP相互独立关联,这可能是TREX适应mRNP形状和大小多样性所必需的。作者预测,2到3个TREX复合物可同时结合到平均含3500个mRNA核苷酸的人类mRNP上。
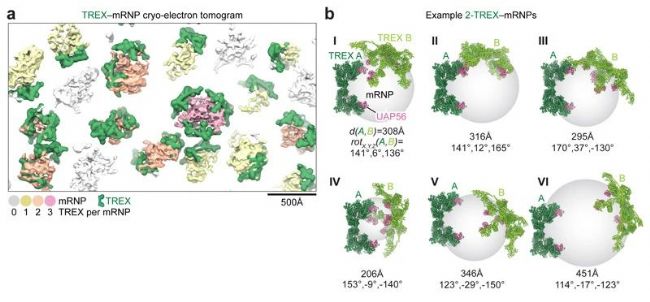
图4a. 降噪后TREX - mRNP冷冻电镜层析图;b. 含有两个TREX复合物的TREX - mRNPs图
mRNP形成致密小球
mRNPs形成致密的球体,表面的TREX复合物发挥调节作用,内部蛋白(如SRSF家族蛋白)则发挥组织作用。
为比较研究TREX - mRNP结构中TREX及mRNP的环境亲和力,作者建立了如下实验:使用CRISPR-Cas9敲入系统,获得GFP-THOC5及GFP-EIF4A3 的K562细胞系(THOC5为TREX亚基;EIF4A3为EJC亚基),将核提取物与携带荧光蛋白 AF647 的抗GFP纳米体孵育。将混合物梯度超离心后,使用Sapphire激光扫描成像系统进行成像(GFP和AF647荧光通道检测),检测纳米体对不同GFP融合蛋白组分的亲和力(重梯度组分为TREX-mRNPs GFP融合蛋白;轻梯度组分为游离的GFP-THOC5及GFP-EIF4A3蛋白)。结果显示(扩展数据图10b,c),纳米体与GFP-THOC5在所有组分都能很好地结合;相反,纳米体在重梯度组分中与GFP-EIF4A3结合较差。可见,TREX - mRNP结构中TREX的环境亲和力强于mRNP。
此外,所有内源性标记的GFP-THOC5或慢病毒过表达的THOC1-GFP核提取物,均可被抗GFP纳米体免疫沉淀,而GFP-EIF4A3的反应效率则很低(扩展数据图10e)。Sapphire激光扫描成像系统检测。这些数据均支持观察到的TREX-mRNP结构。
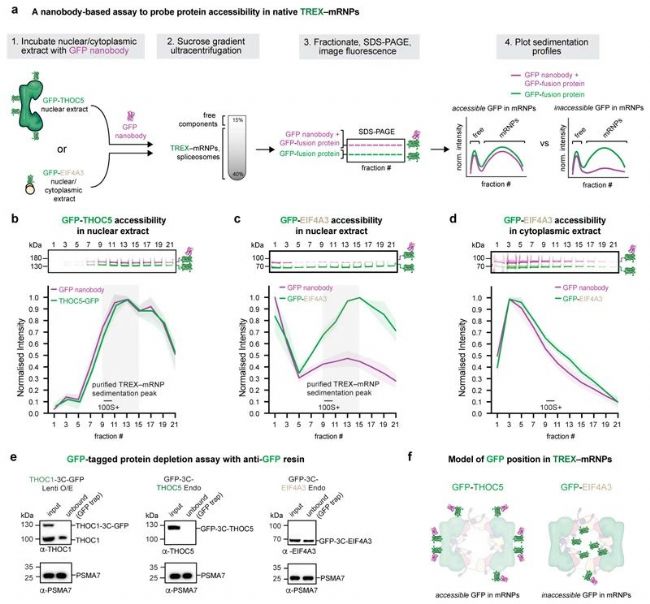
扩展图10a. 探测mRNP复合物中蛋白质可及性的实验示意图;b. 核提取物GFP-THOC5在不同梯度组分中的SDS-PAGE荧光信号;c.核提取物GFP-EIF4A3在不同梯度组分中的SDS-PAGE荧光信号;e. Western blot显示THOC1-GFP (异位过表达; Lenti O/E) , GFP-THOC5(内源性标记; endo) 及GFPEIF4A3(内源性标记)的消耗速率(图b,c,d,e为Sapphire激光扫描成像系统拍摄);f. GFP标记的THOC5或EIF4A3在TREX-mRNPs中可及性模型。
3 mRNA包装和输出模型
我们的研究结果提出了一个TREX依赖的核mRNA包装和跨mRNA尺度输出的模型(图5)。
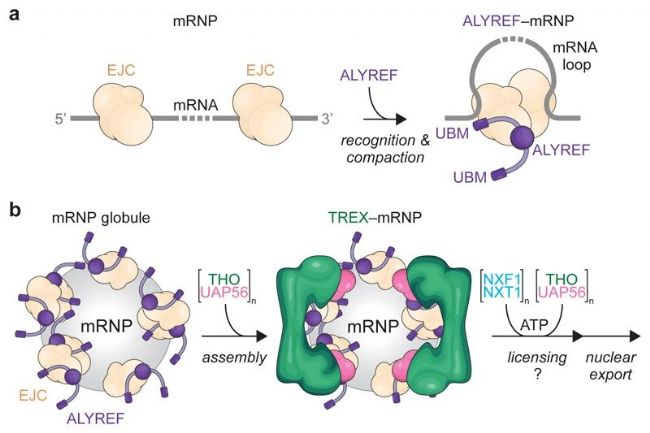
图5. mRNA包装模型
其中,TREX可能通过四种机制促进mRNA的生物发生:
一、TREX的包被在空间上限制mRNP。THO28、41和ALYREF53与UAP56的联合多价结合可能共同刺激UAP56的ATP酶活性,调节随后的mRNP重塑和mRNA输出因子加载(图5) 。二、在TREX-mRNP结构中,THO复合物位于mRNP表面,利于在核输出之前从mRNP中释放。三、核内mRNA转录可避免有害的RNA-DNA相互作用或mRNP成熟过程中RNA-RNA接触。反之,TREX缺陷导致DNA附近松散mRNA的积累,将造成基因组不稳定。四、TREX包被可以解释mRNPs如何免受核mRNA降解机制的影响。
成熟的mRNP具有与TREX类似的球状结构,可更有效地通过拥挤的核质和核孔复合物,mRNA输出因子在其中被装载到mRNP表面,使其通过核孔复合物的疏水屏障进行运输。
4 总结与讨论
核mRNP的识别包装依赖于特异性蛋白质-蛋白质和非特异性蛋白质- mRNA的相互作用,这可以解释如何在不区分长度和序列不同的mRNA的情况下鉴定成熟的mRNA。mRNP独特的球状分子结构,对调节核mRNA的表达,维持核浆中mRNA的流动性,并促进mRNA核输出具有重要意义。
原文链接:
https://www.nature.com/articles/s41586-023-05904-0#Sec84
创新驱动性能, Azure Biosystems全新推出Sapphire FL,是继革新专利产品Sapphire激光扫描成像系统后的又一力作,实现多通道荧光检测、在线活体成像、突破 fg级检测灵敏度,具有可任意组合、自主更换的激光器及滤光片,开创生物分子成像又一新纪元!

